- Home
- Informazioni di Base
- Feed dalla letteratura
- Prospettive PNEI
- Immunergic Neurotransmission
- Filosofia PNEI
- Sui Passi della Felicità
- Iconografia
- Master PNEI UnivAq (SIPNEI)
- Master Interateneo II Livello
- Link Esterni
- Risorse Bibliografiche
- Annunci pubblicitari
- Dedica
- Chiedi una consulenza
- Sostienici
PsicoNeuroEndocrinoImmunologia
Una finestra sul mondo della PNEI
Prospettive PNEI
Fondamenti scientifici
1) l'asse ipotalamo-ipofisi-surrenalico;
2) l'asse ipotalamo-ipofisi-tiroideo;
3) l'asse ipotalamo-ipofisi-gonadico.
Più generalmente, in stretta connessione con la regolazione dei 3 assi, si può parlare di asse ipotalamo-ipofisi-immunitario poichè, come vedremo, le cellule del sistema immunitario vengono ad essere controllate in diversi modi dai fattori che regolano i 3 grandi assi.
Ad integrare ed accelerare le risposte omeostatiche fornite dai 3 grandi assi, capaci di indurre adattamenti dell'organismo verso l'ambiente nell'arco di diverse ore o giorni, entra in gioco un altro asse fondamentale per la regolazione rapida (fuga, lotta, intensificazione dello sforzo, accelerazione delle capacità intellettive, ma talvolta anche blocco emotivo e reattivo) dell'organismo all'ambiente: l'asse ipotalamo-spino-midollare. Esso, attraverso le connessioni dirette costituite dal Sistema Nervoso Autonomo con i diversi organi e, in modo speciale con la midollare del surrene, è capace di agire nell'arco di pochissimi secondi incrementando la secrezione adrenergica e noradrenergica sia in maniera sistemica (aumento del metabolismo basale e del consumo di ossigeno tessutale, glicogenolisi con iperglicemia, deviazione del circolo ematico verso gli organi vitali con vasocostrizione cutanea e splancnica, aumento della pressione arteriosa sistemica, aumento della reattività muscolo-scheletrica, aumento dell'attenzione e dei sistemi d'allerta) che localizzata (accelerazione del battito cardiaco, broncodilatazione con vasocostrizione polmonare, vasocostrizione epatica, splenocostrizione, riduzione delle secrezioni gastrointestinali, dilatazione pupillare, ritenzione di urina per rilassamento della parete vescicale con sfinterocostrizione).
Centro di comando: l' Ipotalamo (Hypothalamus)
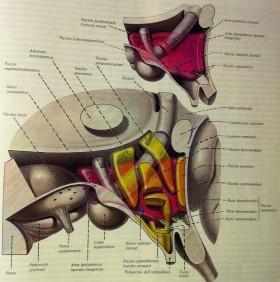
Ogni vissuto, esperienza, decisione, stato d'animo, emozione, pensiero viene comunicato e, per così dire vagliato, a livello ipotalamico. La struttura dell' ipotalamo è molto complessa e addirittura non vi è completo accordo sui confini anatomici topografici di questa regione.
Viene generalmente suddiviso, senza consenso unanime, in 3 regioni procedendo in senso antero-posteriore: la regione sopraottica, la tubero-infundibolare e la mammillare. Un'altra suddivisione, prendendo come riferimento il piano sagittale, ne delinea una parte periventricolare, una intermedia (mediale) e una laterale.
Riportiamo un elenco delle principali strutture che compongono l'ipotalamo:
- parte periventricolare: parte interna del nucleo preottico, nucleo sovrachiasmatico, nucleo paraventricolare, nucleo arcuato (o infundibolare), nucleo posteriore;
- parte intermedia: parte intermedia del nucleo preottico, nucleo anteriore, nucleo dorsomediale, nucleo ventromediale, nuclei premammillari;
- parte laterale: parte laterale del nucleo preottico, nucleo sovraottico, nucleo laterale, nucleo tuberomammillare, nuclei tuberolaterali.
Ciascuna delle regioni ipotalamiche è quindi un complesso sistema di nuclei, fibre afferenti ed efferenti, formazioni grigie e connessioni neuronali capaci di modulare l'omeostasi generale dell'organismo (dall'equilibrio idrosalino alla temperatura corporea) e di intervenire in maniera consistente sul comportamento generale dell'individuo (reazioni emotive, lotta o fuga, battito cardiaco, concentrazione, reattività, sonno-veglia, ecc...).
In questo senso l'ipotalamo si trova al centro di una rete estremamente interconnessa di funzioni neuroendocrine che mirano alla stabilità dell'essere umano: nelle sue funzioni organiche e psichiche, nella modulazione delle risposte verso i patogeni, nel controllo delle reazioni immunitarie, nel mantenimento dell'equilibrio metabolico, ma anche nella fisiologia dell'endotelio vascolare (mediatori vasoattivi e vasoprotettivi), nella funzionalità delle barriere mucose aero-bronchiali, urinarie, genitali e gastroenteriche.
Questo complesso sistema integrato può reggersi solo grazie ad una fitta rete fisica (sistema neuroeffettore diffuso, attraverso gangli, fibre e terminazioni nervose regolatorie, sinapsi elettriche) e biochimica (mediatori endocrini, neuromediatori -> trasduzione neuro-endocrina, sinapsi chimiche) che va ad estendersi a tutto l'organismo, cute, mucose, organi cavi e parenchimatosi, organi di senso e sistema emolinfopoietico.
Nella sola regione preottica ipotalamica (tra corpi neuronali, assodendriti, vescicole sinaptiche) sono state identificate almeno una cinquantina di molecole con funzioni, talora note talora meno note, neuroendocrine, neuromodulatorie, neuroendocrinoimmunitarie. Ne elenchiamo alcune: fra le più comuni abbiamo noradrenalina, adrenalina, serotonina, dopamina, acetilcolina, istamina, glutammato, aspartato, acido gamma-amminobutirrico, glicina che intervengono nella regolazione della scarica neuronale, nella neurocomunicazione, nella bilancia simpato-vagale e nella regolazione dei processi omeostatici psichici (fra cui aggressività, tono dell'umore, ansia), omeostatici reattivi (sistema vegetativo, sonno-veglia) e omeostatici immunitari (temperatura corporea, asse ipotalamo-ipofisario); poi abbiamo veri e propri ormoni e neuro-ormoni, quali ossitocina, vasopressina, CRF (ma anche ACTH), TRH, somatostatina, LHRH, alfa e beta-MSH, neurotensina, colecistochinina, VIP, sostanza P, quasi come ad un ulteriore livello di controllo riguardante la vita di relazione (si pensi all'ossitocina, ormone della maternità che pare avere un importante ruolo nei comportamenti empatici), riguardante il metabolismo generale (senso di fame e sazietà, controllo tiroideo, controllo corticosurrenalico, controllo degli ormoni sessuali), riguardante il bilancio idro-osmotico (come la vasopressina, ormone antidiuretico); infine abbiamo una enorme quantità di peptidi, citochine, neurochine, interleuchine, che, quasi a costituire un terzo livello operativo di controllo e regolazione, agiscono in maniera estremamente versatile dal centro alla periferia e viceversa, dai neuroni a tutti i tessuti, dai terminali assonici alle cellule immunitarie, agli endoteli, alla barriera mucocutanea, in una fitta rete neurobiochimica bidirezionale. Fra queste molecole citiamo le interleuchine, le prostaglandine, l'angiotensina 2, la dinorfina e tutto il gruppo delle encefaline/endorfine.
Da questo quadro, puramente illustrativo della complessità delle funzioni che si svolgono a livello dell'ipotalamo, l'attuale ricerca scientifica si è indirizzata alla sempre più precisa definizione del network a monte (funzioni corticali superiori, integrazione degli stimoli provenienti dall'esterno, loop neurocomportamentali) e a valle (regolazione viscerale, riflessi autonomici, loop neuroimmunitari).
Per fare ciò, pur nelle diverse teorizzazioni e correnti scientifiche, si è gettata una base abbastanza condivisa che è stata denominata sistema neuroendocrino diffuso.
Il Sistema Neuro-Endocrino Diffuso (SNED)
Gli scienziati che si occupano di PNEI sono sostanzialmente d'accordo su un punto fondamentale, che rappresenta il cardine stesso di questa disciplina: l'organismo umano è costituito da una organizzazione gerarchica non rigida. I rapporti tra centri "superiori" ed "inferiori", tra "comando" ed "effettore" si realizza in una immensa rete di interconnessioni dove la causa produce l'effetto, ma allo stesso tempo l'effetto diventa causa grazie a meccanismi controregolatori.
La cosa che più affascina gli studiosi di PNEI è come ogni piccola variazione psico/neuro/endocrina sia finemente regolata su piani molteplici capaci di correre paralleli o di intersecarsi (interagendo l'uno con l'altro) dando origine ad una possibilità di stati psicofisiologici tendente all'infinito. Un immenso sistema di trasduzione dei segnali provenienti dall'esterno è continuamente al lavoro nel nostro organismo ad un livello interconnesso di tipo psico-organico. Il nostro mondo interiore affinchè sia tale (cioè reale) e valido (cioè funzionante) deve cimentarsi positivamente con le condizioni esterne, dandovi risposte adeguate.
Questo ragionamento ha condotto a postulare l'ipotesi che non solo terminazioni nervose di vario tipo debbano essere coinvolte nella trasmissione dei segnali al "centro" e da qui di nuovo alla periferia - si pensi alla sensazione di caldo che viene condotta ed eleborata a livello prima sottocorticale e poi corticale (fino al livello di coscienza) e quindi torna alla cute sottoforma di vasodilatazione, sudorazione, ecc... - ma anche nel sistema endocrino debbano essere presenti simili meccanismi. D'altronde un meccanismo analogo coinvolge anche il sistema immunitario, secondo un modello di riconoscimento, trasduzione e risposta.
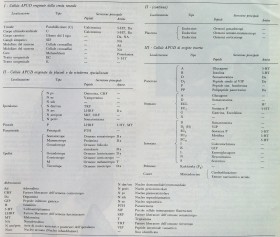
Dove si trovano quindi le cellule recettrici-effettrici del sistema endocrino? La risposta oggi sembra essere: pressochè ovunque. Gli studi sullo SNED iniziarono negli anni '30 ad opera di Friedrich Feyrter (1895-1973), il quale documentò la presenza di cellule chiare nell'intestino e nel pancreas. Fu in seguito Anthony Guy Everson Pearse (1916-2003) che classificò tali cellule nel sistema APUD (amine precursor uptake and decarboxylation) negli anni '60.
Seguendo questo link troverete una tabella con riportate le oltre 40 tipologie di cellule che costituiscono lo SNED; possiamo vedere che coinvolgono praticamente tutti i tessuti, dal tratto urogenitale alle miofibre cardiache, dal sistema nervoso centrale alla cute. Il meccanismo d'azione attraverso il quale queste cellule agiscono e si interconnettono è estremamente complesso, con molti aspetti che ancora richiedono chiarificazione. Un esempio schematico di funzionamento di una cellula enteroendocrina è riportato nella figura al presente link; la possibilità delle cellule SNED di comunicare nelle regioni circostanti (azione ormonale autocrina e paracrina) e/o remote (funzione telecrina) fa sì che questo "sistema nei sistemi" sia capace di coordinare il sistema endocrino e nervoso al fine di mantenere l'omeostasi dell'organismo. Inoltre, poichè i molti mediatori secreti sono in grado di intervenire nella regolazione delle cellule immunitarie (e molti di essi di essere prodotti dalle cellule immunitarie stesse), lo SNED costituisce un punto chiave della fine regolazione del tono immunitario locale e generale.
L'interfaccia neuro-endocrino-immunitaria
Il sistema immunitario è classicamente distinto nelle sue due branche effettrici che vedono coinvolte cellule specializzate. Da un lato abbiamo la risposta immunitaria aspecifica (detta anche naturale o innata); dall’altra, l’immunità specifica (detta anche acquisita o adattativa). Molto sinteticamente, le due branche interagiscono tra loro strettamente al fine di proteggerci dai patogeni, seppure la risposta innata, guidata da cellule e molecole con attività generica (fagocitica, opsonizzante, proinfiammatoria), e quella specifica, guidata da cellule e molecole ad attività antigene-specifica (anticorpi, risposte antigene-relate), possano mantenere una teorica autonomia funzionale.
Sia la risposta innata che acquisita vengono suddivise in un braccio effettore cellulare ed in uno umorale: la risposta innata vede in gioco come elementi cellulari i granulociti (neutrofili, eosinofili, basofili), i macrofagi, le cellule dendritiche, le cellule NK e alcuni elementi della neuroglia, mentre sul piano umorale i fattori del complemento, istamina, prostaglandine, leucotrieni, le proteine della fase acuta (tra cui la proteina C reattiva); la risposta acquisita vede sul versante cellulare i l
Si deve principalmente al lavoro di J. Edwin Blalock la dimostrazione dell’esistenza di una interfaccia che pone in comunicazione i sistemi nervoso ed endocrino con quello immunitario. L’interfaccia è costituita dalla capacità di pressoché tutti gli elementi costitutivi dei tre sistemi di produrre molecole e sostanze condivise e di riconoscerne la presenza tramite specifici recettori.
Nella figura al presente link viene schematizzata la grande capacità sintetizzante e recettoriale dei l
Bisogna tuttavia precisare come gli studi atti a dimostrare la capacità di produrre determinate molecole siano principalmente in vitro. Questo ha da un lato il vantaggio di rendere i risultati più specifici per le cellule in esame ma dall’altro il limite di non poter determinare la reale portata in vivo della produzione di tali molecole. In altre parole, quale è veramente l’impatto nell’essere umano di tale sintesi in tali cellule? E’ significativo o è trascurabile? Dobbiamo tenere presente infatti che tutte le cellule del nostro organismo hanno lo stesso corredo cromosomico e gli stessi geni (fatta eccezione per le cellule sessuali, ossia spermatozoi e ovociti): ciò che le differenzia non sono i geni ma la loro diversa espressione nei diversi organi e tessuti. In linea teorica qualsiasi cellula del nostro organismo potrebbe essere indotta a sintetizzare qualsiasi sostanza prodotta fisiologicamente da un’altra cellula.
Fatta questa precisazione, procediamo col vedere le interazioni più frequenti e, per così dire, più consistenti a livello dell’interfaccia neuro-endocrino-immunitaria. Per primo, c’è uno stretto circuito regolatorio mediato dall’asse ipotalamo-ipofisi-surrene: la modulazione che si verifica reciprocamente tra SNC e immunità è a questo livello fondamentale. Stress, fatica, restrizione calorica, deprivazione di sonno, sforzi ecc… attivano la produzione di CRH ipotalamico con conseguente incremento dell'ACTH e dei valori di cortisolo circolanti. Le cellule immunitarie (neutrofili, macrofagi, l
- inibizione dell’espressione endoteliale di molecole di adesione quali ELAM-1, ICAM-1, E-selectina e del CD18 (meccanismi in gioco anche nella centralizzazione nel torrente ematico dei neutrofili e loro inibizione nel raggiungere i tessuti infiammati, della riduzione numerica dei monociti e ridistribuzione in generale nei siti di deposito quale il midollo osseo);
- inibizione della secrezione delle citochine macrofagiche quali IL-1, IL-6, IL-8, MCP-1, TNF-alfa e delle l
- blocco dell’ espressione di antigeni HLA-II sui macrofagi, sulle cellule di Langerhans e sulle cellule dendritiche;
- inibizione della sintesi delle proteine complementari e induzione dell’apoptosi negli eosinofili e nei l
Da questa breve rassegna sugli effetti immunologici mediati dal cortisolo e, quindi, controllati dal circuito a retroazione costituito dall’asse ipotalamo-ipofisi-surrene, possiamo intuire la fondamentale connessione tra sistema endocrino e immunitario. Inoltre, essendo le stesse cellule immunitarie (in particolare l
L’interfaccia neuroendocrino-immunitaria vede in primo piano anche la midollare del surrene ed in generale il sistema nervoso adrenergico. Pressoché tutte le cellule immunitarie sia a livello del braccio innato che acquisito dell’immunità sono dotate di recettori per adrenalina e noradrenalina, in particolare di beta-recettori (più frequentemente beta-2). Recettori alfa-adrenergici sono presenti sulle cellule dendritiche e monocitarie, mentre beta-recettori sono presenti sui neutrofili, sui monociti/macrofagi, sulle cellule dendritiche, sulle cellule NK ed in molte popolazioni T e B l
Ci pare importante ora evidenziare che, nell’interpretazione degli effetti adreno-mediati sul sistema immunitario, grande importanza ha l’espressione recettoriale cellulare, che varia notevolmente a seconda dello stato (naive, quiescente, attivata, iperattivata) della cellula immunitaria in esame. Ad esempio, uno stimolo noradrenergico su cellule NK coltivate con IL-2 mostravano una ridotta espressione di IFN-gamma e TNF-alfa con conseguente effetto inibitorio sulla loro attività. L’ IL-2 viene prodotta principalmente dai l
Provando a trarre delle conclusioni generali, assai diverso può essere l’effetto della stimolazione adrenergica al di fuori di un sistema immunitario attivato, durante la sua attivazione o dopo di essa, rispettivamente con effetti stimolatori nel primo caso, inibitori nel secondo e trascurabili nel terzo. Altro dato importante da tenere presente, l’attivazione immunitaria può essere sistemica (definita anche come SIRS, systemic inflammatory response syndrome, cioè una sindrome da risposta infiammatoria generalizzata che si caratterizza generalmente per la presenza di febbre, leucocitosi, tachicardia, tachipnea) o localizzata (infezioni localizzate, traumi limitati) dando ragione di effetti diversi su popolazioni cellulari nello stesso individuo ma in contesti tessutali specifici.
Anche la stimolazione colinergica regola l’immunità così come quest’ultima interviene nella regolazione della bilancia simpato-vagale. Il nervo vago costituisce un importante sistema antinfiammatorio colinergico capace di intervenire sia nell’infiammazione sistemica (ad es. in corso di endotossinemia) sia localizzata. L’acetilcolina si lega alla subunità alfa-7 del recettore nicotinico espressa sui macrofagi inibendone il rilascio delle citochine proinfiammatorie quali TNF-alfa, IL-1, Il-6, IL-18, HMGB1 senza interferire con la produzione di citochine antinfiammatorie quale IL-10, modulando quindi potentemente la risposta infiammatoria. I recettori nicotinici sono altresì presenti sulle cellule endoteliali, dove lo stimolo colinergico è in gradi di indurre ipoespressione delle molecole di adesione per diversi leucociti, soprattutto i neutrofili, riducendo quindi la loro migrazione con conseguente limitazione della flogosi. L’ipertono vagale è tuttavia talvolta associato alle sindromi respiratorie broncocostrittive quali asma e broncopneumopatia cronica ostruttiva. In questo caso tuttavia l’azione è mediata a livello dei recettori muscolari bronchiali muscarinici, i quali inducono contrazione della muscolatura liscia bronchiale. I bloccanti prevalentemente muscarinici, quali tiotropio, oxitropio e ipratropio sono in grado di esercitare un effetto antimuscarinico cercando di mantenere i benefici dell’ipertono vagale sui recettori nicotinici.
I l
Gli estrogeni, come ben noto da parecchi anni, sono capaci di intensificare l’attività l
I l
A scopo riassuntivo riportiamo alcune tabelle tratte principalmente dalla bella revisione PNEI nell’ambito del Trattato Italiano di Medicina di Laboratorio fondato da Angelo Burlina ed edito da Piccin (Vol II/2).
Principali influenze del sistema neuroendocrino su quello immunitario.
Effetti delle citochine sull’asse ipotalamo-ipofisi-surrene.
Effetti delle citochine sull’asse ipotalamo-ipofisi-gonadi.
Effetti delle citochine sull’asse ipotalamo-ipofisi-tiroide.
L’interfaccia endocrino-immunitaria vede anche in azione la vitamina D3 che, per certi aspetti, ha caratteristiche assai vicine al concetto di ormone (mediatore intercellulare sistemico) più che di vitamina (ossia cofattore necessario allo svolgimento di reazioni enzimatiche). Infatti essa interviene non solo nel metabolismo del calcio ma anche nella regolazione del sistema immunitario:
- a livello delle cellule dendritiche inibisce l’espressione dei complessi peptide/MHC II modulando quindi la presentazione dell’antigene in senso inibitorio;
- ancora a livello delle cellule dendritiche, inibisce la produzione di IL-12 con la conseguente induzione di una risposta Th2 invece che Th1;
- inibizione T l
- induzione dei l
E’ necessario comunque precisare che in vivo le concentrazioni di vitamina D3 richieste per la modulazione del sistema immunitario sono generalmente maggiori di quelle fisiologiche circolanti e quindi solo raggiungibili per valori sovrafisiologici che si correlano a iperaccumulo di calcio.
Per concludere, senza pretesa di esaustività di un argomento così complesso e articolato, il sistema neuroendocrino ed il sistema immunitario sono intimamente connessi e reciprocamente influenzati a livello di una vastissima interfaccia costituita da recettori e molecole capaci di mantenere l’omeostasi dell’organismo. A loro volta tali molecole sono in grado di influenzare direttamente l’eccitazione o l’inibizione neuronale attraverso diversi meccanismi che vedono in gioco circuiti elettrici e biochimici tra tutti quegli elementi cellulari che vanno a costituire il sistema nervoso centrale (SNC) ossia, oltre ai neuroni, anche le cellule gliali, le cellule neuro-endoteliali, le cellule neuro-endocrine e le cellule neuro-immunitarie (ossia quelle cellule immunitarie periferiche che per diversi motivi fisiopatologici sono migrate a livello del SNC). In tal senso anche il sistema nervoso autonomo gioca un ruolo essenziale: grazie alla sua sensibilità alle variazioni cellulari e umorali che avvengono in periferia è capace di veicolare tali variazioni fino ai centri diencefalici e telencefalici. L’ipotalamo in particolare funziona come un filtro che lascia passare meno dell’1% delle
L'interfaccia psico-immunitaria.
- - - WORK IN PROGRESS - - -
TESTI DI RIFERIMENTO

Psychoneuroimmunology by Ader

Testo di ampio respiro PNEI, curato da LA Wisneski e L Anderson.

Psychoneuroimmunology by Schedlowski and Tewes

Psychoneuroimmunology by Goodkin and Visser

Psychoneuroendocrinology by Wolkowitz and Rothschild

Psychoneuroendocrinology by Czerbska

Psychoneuroimmunology: hypothesis and current research, by Sperner-Unterweger, Fleischhacker, Kaschka.

Psychoneuroimmunology: a behavioral approach. By Singh, Shyam and Singh.

Fundamentals of Psychoneuroimmunology by Song and Leonard

Stress Science: Neuroendocrinology by Fink

Study guide to Psychosomatic Medicine by Bourgeois, Hales and Shahrokh

Human Psychoneuroimmunology by Kavita Vedhara and Michael Irwin

The link between Religion and Health - Psychoneuroimmunology and the Faith Factor by HG Koenig and HJ Cohen

Mind-Body Medicine by Alan Watkins

The Handbook of Stress Science by R.J. Contrada and A. Baum

Stress Management by W. Linden
Handbook of Neuroendocrinology, First Ed, 2012, by Fink G., Pfaff D., Levine J.

Nuova edizione del classico curato da HG Koenig.

Seconda edizione del testo curato da JH Daruna.

Recente testo curato da SC Segerstrom.

The Wiley Blackwell Handbook of Psychoneuroimmunology, curato da AW Kusnecov e H Anisman.

Testo base curato da J.E. Blalock, pioniere della PNEI.

Autore R.C. Gaillard, forte impostazione sperimentale.

Sistema immunitario e tessuto nervoso: dalla fisiologia alla patologia.

Stahl's Essential Psychopharmacology: Neuroscientific Basis and Practical Applications di Stephen M. Stahl, 2013

The American Psychiatric Publishing Textbook of Psychopharmacology a cura di Alan F. Schatzberg, Charles B. Nemeroff